如何选择医疗器械包装运输标准
医疗器械产品上市后会经过存储、运输,从生产商发往物流中心,然后发往经销商或客户端。在产品设计开发阶段,就需要开始对产品上市后储存运输的条件和要求进行设计,比如产品上市后的物流和运输的路径,以及储存和运输的条件等等。分析整个过程中可能存在的风险。咨询电话: 13816144967 (微信同号)

注册技术审查指导原则:温度、湿度、空气压力、振动、冲击、堆码等环境及机械危害因素会对产品产生不利影响的话,需要保证产品(包装保护)能满足运输、仓储的要求。
注册资料申报要求:包装及包装完整性在宣称的有效期内以及运输储存条件下,保持包装完整性的依据。目前包装验证依据使用的验证标准较多,包括ASTM D4169 DC3 & DC13、ASTM D7386、ISTA 3A、3B&3E、ISTA 1&2系列、ISO 11607、GB/T 4857、GB/T 19633.1、GB/T 14710、YY/T 0681.15等。
医疗器械包装运输验证标准如何选择
国内注册用:建议优先选用GB/T 4857、YY/T 0681.15,其次ASTM D4169、ISTA 3A、 ISTA 3B、ISTA 3E。
FDA、CE注册用:建议选用 ASTM D4169、ISTA 3A、ISTA 3B、ISTA 3E。
国内、FDA、CE注册用:建议优先选择ASTM D4169,其次ISTA 3A、ISTA 3B、ISTA 3E。咨询电话: 13816144967 (微信同号)
各类标准适用范围:
ISTA 3系列标准适用范围:
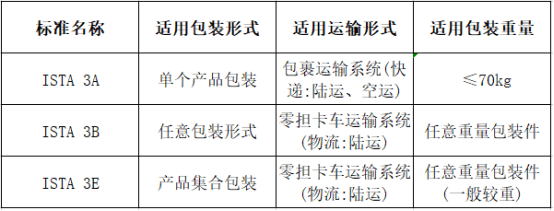
ASTM D4169标准适用范围:
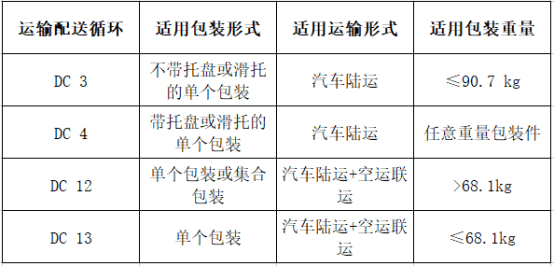
YY/T 0681.15标准适用范围及测试类别:
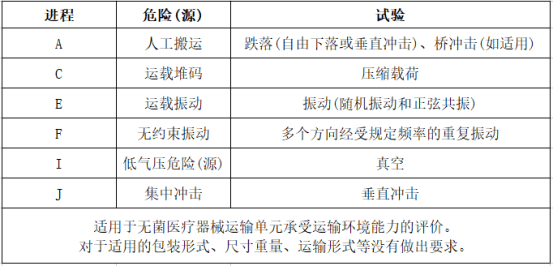
咨询电话: 13816144967 (微信同号)




